降香檀叶的非黄酮类成分研究
降香檀(DalbergiaodoriferaT.Chen)为豆科(Leguminosae)黄檀属乔木,原产海南,见于白沙、东方、乐东和崖县,又名海南黄花梨。其心材红褐色,木质坚硬,纹理清晰,有光泽,干燥后不变形、不开裂,耐湿耐腐蚀,并有独特的香气,是制作家俱和工艺品的优质材料;还供药用,称降香,
收载于我国药典中,有化瘀止血,理气止痛之功效,用于吐血,衄血,外伤出血,肝郁胁痛,胸痹刺痛,跌扑伤痛,呕吐腹痛[1–2]。因乱砍滥伐,现存降香檀数量少,是珍稀红木树种,为二级保护植物。在我国华南地区有种植,但由于该树种生长极其缓慢,成材需数十年乃至上百年时间。降香檀叶近革214热带亚热带植物学报第27卷
质,卵形或椭圆形,叶长15~25cm,有淡淡的香味,可再生,资源丰富,值得开发利用。降香檀心材的化学成分主要为挥发油类和黄酮类,含量约为3.79%和2.50%。挥发油成分主要为橙花叔醇、2,4-二甲基-2,4-庚二烯醛、氧化石竹烯、2,4-二甲基-2,6-庚二烯醛、蒎烯、金合欢醇等,以橙花叔醇含量高[3]。黄酮类成分已报道了90多个化合
物,包括黄酮、异黄酮、二氢黄酮、二氢异黄酮、黄烷、异黄烷、新黄酮、查尔酮、紫檀素、双黄酮、Xanthone等结构类型,以异黄酮类为主[4–8]。此外,降香檀心材中还报道了17个倍半萜类、6个芳基苯唑呋喃类、2个木脂素类、2个脂肪酸类和1个烷基酮类化合物[4–6]。降香檀叶的挥发油成分主要有2-甲氧基-
4-乙烯基苯酚、棕榈酸、苯酚、2-甲基-6-羟基喹啉和17个低含量成分等,与心材相比,种类和含量都有明显差别[3,9]。降香檀叶中的黄酮类成分仅报道了鹰嘴豆芽素A(biochaninA)、染料木素(genistein)、鸢尾黄素(tectorigenin)、樱黄素(prunetin)和6-羟基鹰嘴豆
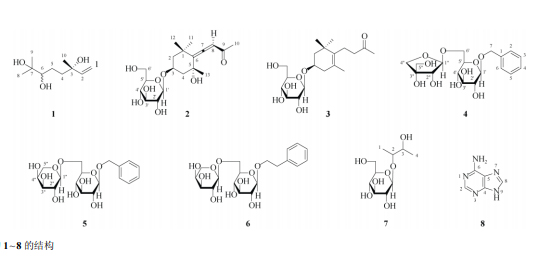
芽素A(6-hydroxybiochaninA)共5个异黄酮类,其他类型化合物未见报道[10–11]。本文报道从降香檀叶中分离得到的1个单萜、2个大柱香波龙烷糖苷、3个芳基糖苷、1个烷基糖苷和1个嘌呤类的结构(图1),这些非黄酮类化合物均为首次从该植物中报道。1材料和方法1.1材料试验材料于2015年12月采自广东省湛江市麻
章区华仁黄花梨种植专业合作社,由科学院华南植物园叶华谷研究员鉴定为降香檀(DalbergiaodoriferaT.Chen)叶。青岛谱科分离材料公司柱层析硅胶(100~200目);烟台江友硅胶开发公司薄层色谱(TLC)HSGF254硅胶板,先紫外显色,再喷洒硫酸-乙醇烤热显色;利穗科技(苏州)公司中压色谱柱[填料Chromatorex
C18SMB100,粒径20~45μm,内柱长400mm,内径(i.d.)25mm];Cosmosil公司5C18-MS-II色谱柱(5μm,分析用250mm×4.6mmi.d.,制备用250mm×20mmi.d.);GEHealthcareBio-SciencesAB公司葡聚糖凝胶LH-20。1.2仪器和试剂
利穗科技(苏州)公司EZPurifier100中压液相色谱(MPLC)仪;岛津公司LC-6AD液相色谱(HPLC)仪和RID-10A示差检测器;北京创新通恒科技公司LC3000HPLC仪和UV3000检测器;应用生物系统公司MDSSCIEXAPI2000LC-MS/MS联用仪,电喷雾(ESI)电离源;Bruker公司Ascend500
核磁共振(NMR)仪,化学位移值(δ,ppm)以溶剂峰为参照。提取用乙醇为食用级,萃取和柱层析用氯仿、正丁醇、甲醇为分析纯,液相色谱用甲醇和乙腈为色谱纯。1.3提取和分离新鲜降香檀叶在50℃鼓风烘干,粉碎。取粉末2700g,用95%乙醇浸泡3次,溶剂体积依次为13.5、10.8和10.8L,每次浸泡2d,不时用棍棒搅
动,放出溶液,过滤,减压浓缩至干,得乙醇提取物357g。滤渣加水10.8L,煮沸0.5h,抽滤,滤液减压浓缩至4.5L。将乙醇提取物溶于水煮液中,倒入分液漏斗,用氯仿萃取4次,每次3L,合并萃取液,用无水硫酸钠脱水,减压浓缩至干,得氯仿萃取物141g。水溶液用正丁醇萃取5次,每次3L,合并萃取液,脱水,减压浓缩至干,得正丁醇萃取
物167g。取正丁醇萃取物165g,用甲醇溶解,加入硅胶200g,拌匀,减压抽干溶剂,倒出,研磨,过40目筛。取硅胶3300g,用氯仿搅匀,倒入层析柱中,缓慢放出溶剂,用纸筒敲打柱壁,至硅胶面不再下降为止。倒入样品,敲实,层析柱内径11.8cm,硅胶高度78.1cm,柱体积8536mL。依次用氯仿(18L)、
氯仿-甲醇混合液[95∶5,27L→9∶1,24L→85∶15,32L→8∶2,25L→75∶25,40L→7∶3,26L→6∶4,17L,V/V(下同)]、甲醇(10L)洗脱,收集洗脱流份,每份1L,减压浓缩至干,TLC检查,合并主点相同的流份,得组分DLB1~DLB23。DLB6(1.42g)经
MPLC分离,以甲醇-水梯度洗脱,流速10mLmin–1,流份经TLC检查,合并为亚组分DLB6-1~DLB6-6。DLB6-2经凝胶柱分离,用甲醇洗脱,洗脱物经HPLC纯化,以甲醇-水(18∶82)为流动相,流速6mLmin–1,得化合物1(保留时间tR=61.1min,8mg)。DLB8(1.62g)经MPLC分离,以甲醇-水梯度洗脱,流份
经TLC检查,合并为亚组分DLB8-1~DLB8-19。DLB8-10经凝胶柱分离,以甲醇洗脱,洗脱物经HPLC纯化,以乙腈-水(15∶85)为流动相,流速7mLmin–1,第2期吕玲等:降香檀叶的非黄酮类成分研究215得化合物3(tR=107.0min,2.6mg)。DLB9(2.08g)经MPLC分离,以甲醇-水梯度洗脱,流份经TLC
检查,合并为亚组分DLB9-1~DLB9-15。DLB9-2有白色沉淀析出,过滤,得化合物8(12.1mg)。DLB12(6.27g)经MPLC分离,以甲醇-水梯度洗脱,流份经TLC检查,合并为亚组分DLB12-1~DLB12-22。DLB12-3(327mg)经凝胶柱分离,以甲醇洗脱,得化合物7(30.2mg),DLB12-8(290mg)经凝胶柱分
离,以甲醇洗脱,流份经TLC检查,合并为组分DLB12-8-1~DLB12-8-5。DLB12-8-2经HPLC纯化,以乙腈-水(10∶90)为流动相,流速7mLmin–1,得化合物2(tR=42.0min,27.4mg)。DLB12-8-3经HPLC纯化,以乙腈-水(12∶88)为流动相,流速7mLmin–1,得化合物4(tR=32.5min,17.8mg)。
DLB13(2.87g)经MPLC分离,以甲醇-水梯度洗脱,流份经TLC检查,合并为亚组分DLB13-1~DLB13-16。DLB13-6经凝胶柱分离,以甲醇洗脱,洗脱物经HPLC纯化,以甲醇-水(30∶70)为流动相,流速6mLmin–1,得化合物5(tR=71.1min,18.6mg)。DLB13-7(135mg)经凝胶柱分离,以甲醇洗脱,流
份经TLC检查,合并为组分DLB13-7-1~DLB13-7-5。DLB13-7-2(50mg)经HPLC纯化,以甲醇-水(25∶75)为流动相,流速7mLmin–1,得化合物5(tR=35.6min,3.2mg)。DLB13-8经凝胶柱分离,用甲醇洗脱,洗脱物经HPLC纯化,以甲醇-水(30∶70)
